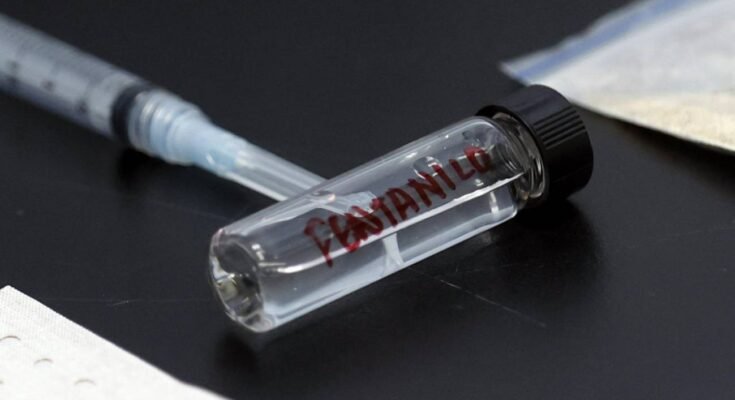
La justicia investiga posibles partidas contaminadas de fentanilo producidas por los laboratorios HLB Pharma y Ramallo, vinculadas a la muerte de 96 pacientes. Desde año 2018, informes de supervisión indicaron “desvíos de calidad” graves, pero estos señalamientos no ascendieron en la cadena de mando ni resultaron en medidas correctivas oportunas. La situación revelaría una serie de fallas institucionales en el Instituto Nacional de Medicamentos (INAME) y posibles redes flags que, según las pesquisas, no fueron adecuadamente gestionados durante años.
- El fentanilo es un opioide sintético cuyo uso clínico está estrictamente regulado; cuando se maneja fuera de estándares de calidad, puede provocar graves riesgos para la salud y la vida de pacientes.
- HLB Pharma y Ramallo figuran en la investigación judicial como responsables de lotes vinculados a fallecimientos de pacientes, aumentando la presión sobre las autoridades de control sanitario.
Los detalles de la investigación:
- Origen de las sospechas: Partidas de fentanilo asociadas a pacientes fallecidos podrían haber salido de laboratorios que incumplían estándares de calidad.
- Ruptura de la cadena de supervisión: Informes de control de calidad y auditoría interna en 2018 y años siguientes describían “desvíos de calidad” graves en la fabricación.
- Archivos y retrasos: Estos informes habrían sido archivados o no escalados adecuadamente a la alta administración, ralentizando las intervenciones necesarias.
- Responsables institucionales: El Instituto Nacional de Medicamentos (INAME), bajo la dirección de la abogada Gabriela Mantecón Fumadó, estaría en el centro de las investigaciones por su rol en la supervisión y por la presunta inercia ante los avisos de irregularidades.
- Laboratorios bajo escrutinio: además de HLB Pharma y Ramallo, otros laboratorios observados continúan operando, generando preocupaciones sobre posibles déficits en controles y seguimiento.
Implicaciones y posibles consecuencias:
- Seguridad del suministro: Si se comprobara que partidas contaminadas llegaron a pacientes, se exigiría una revisión exhaustiva de las prácticas de fabricación y de las cadenas de suministro farmacéuticas.
- Responsabilidad institucional: Las autoridades sanitarias podrían enfrentar procesos de revisión, sanciones o cambios en la normativa para evitar desvíos similares en el futuro.